
моих комментариев 127
блогов 0
сообществ 88
учебных материалов 2
статьи 1
мастер-класс 0
экскурсий 0
дискуссий 1
новость
|
2 255 532
просмотра
|
2 657
комментариев
|
70
место в рейтинге
|







|
||
Цель работы: научиться определять объем числа моль различных соединений и взвешивать их.
Оборудование: весы болгарские, разновесы, мензурка, колбы, сухие вещества, NaCl-поваренная соль, Na3PO4- фосфатно-кислый натрий, К2Cr2O7 - хромово-кислый калий

Ход работы
M (NaCL)=
- (Na3PO4)=
- (К2Cr2O7 )=
- =Mr*1 моль
- (Na3PO4)=
- (К2Cr2O7 )=
- (NaCl) =
- Взвесьте вещества:
- Насыпьте вещества в мерную колбу и определите объемы сухих веществ, а точнее 1 моль сухого вещества:
- V=
Контрольные вопросы:
Что такое моль?
Что такое атомная масса?
Как определить молярную массу химического соединения?
Условия выполнения задания
1. Место (время) выполнения задания: задание выполняется во время занятия в аудитории
2. Максимальное время выполнения задания: ____40_______ мин.
3. Вы можете воспользоваться учебником, конспектом лекции
Какую химическую посуду вы использовали? Нарисовать.



Лабораторная работа: «Определение элементного состава органических соединений»
Задание на лабораторную работу:
В широкий химический стакан поместите небольшой кусочек парафиновой свечи и подожгите его с помощью горящей лучинки. Обратите внимание на стенки стакана-на них появляются капельки воды. О наличии какого химического элемента в составе парафина они свидетельствуют? Погасите свечу и выньте ее из стакана.
Затем налейте в стакан немного прозрачной известковой воды и осторожно взболтайте. Что наблюдаете? О наличии какого химического элемента свидетельствуют изменения, произошедшие с известковой водой? Запишите уравнения проведенных реакций.
Ход выполнения лабораторной работы, ответы на вопросы:
Появление на стенках стакана капелек воды, после того как зажгли свечу, означает, что в состав парафина входит водород H2.
Уравнение при этом имеет вид:
C17H36 + 26 O2=17 CO2 + 18 H2O
Во второй части опыта прозрачная известковая вода после взбалтывания помутнеет, а это говорит о содержании в парафине углерода.
Уравнение второй части опыта:
CO2 + Ca(OH)2=CaCO3 + H2O
files.school-collection.edu.ru/dlrstore/0abb8980-4185-11db-b0de-0800200c9a66/x10_062.swf
Практическая работа: "Получение этилена дегидратацией этилового спирта"
Задания. 1. Получите этилен из этилового спирта.
2. Проведите характерные реакции для этилена как представителя непредельных углеводородов.
Оборудование. Прибор для получения этилена, штатив с пробирками, стеклянные трубки с оттянутым концом, лучинка, фарфоровая пластинка или чашечка, чашка с песком, лабораторный штатив, горелка, спички, мензурка, свернутая спирально медная проволока, которая должна быть вложена в газоотводную трубку.
Вещества. Этиловый спирт, серная кислота (конц.), раствор бромной воды и розовый раствор подкисленного перманганата калия, промытый и прокаленный речной песок.
Выполнение работы
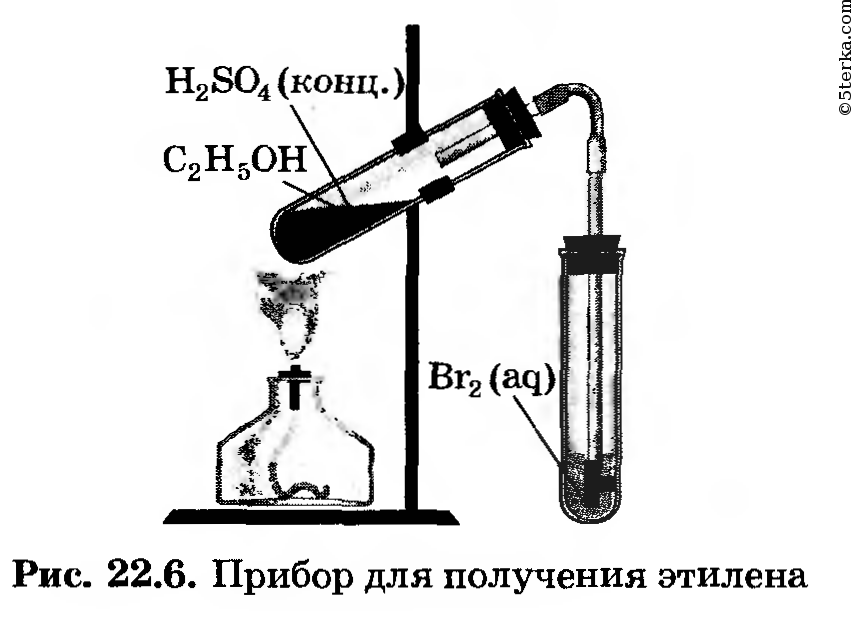
1. Получение этилена. Соберите прибор для получения этилена (рис. 22.6) и проверьте его на герметичность.
Для получения этилена в пробирку поместите 1,5 мл этилового спирта, затем осторожно прилейте 4 мл концентрированной серной кислоты и добавьте в смесь немного прокаленного песка. Закройте пробирку пробкой с газоотводной трубкой и закрепите прибор в штативе.
2. В две пробирки прилейте по 2 мл растворов бромной воды и перманганата калия. Нагрейте в приборе для получения этилена смесь до кипения и, не переставая нагревать, но не перегревая, опустите конец газоотводной трубки сначала в
пробирку с бромной водой, а затем в пробирку с раствором перманганата калия.
Что вы наблюдаете? Составьте уравнения химических реакций: а) получения этилена из этилового спирта; б) взаимодействия этилена с бромной водой.
Направьте конец газоотводной трубки прибора вверх и подожгите лучиной выделяющийся этилен. Отметьте характер пламени. Внесите в пламя этилена на несколько секунд фарфоровую пластинку или чашу. Что вы наблюдаете?
Вдувайте воздух через стеклянную трубку с оттянутым концом в среднюю часть пламени этилена. Как изменяется яркость пламени? Почему? Составьте уравнение реакции горения этилена.
Получение этилена.
Концентрированная серная кислота обладает свойством отбирать воду у других веществ. Это свойство использовано для получения этилена.
Вода частично конденсируется на стенках пробирки и скатывается обратно в раствор. Этилен уходит по газообразной трубке. Свойства этилена:
При пробулькивании этилена через раствор бромной воды и перманганата происходит обесцвечивание.
Этилен горит желтым пламенем, при внесении фарфоровой чашки она чернеет, из-за неполного сгорания этилена образуется свободный углерод — сажа черного цвета. При вдувании воздуха в пламя этилена происходит полное сгорание этилена, и пламя из желтого становится синим.
Испытание растворов щелочей индикаторами
Взаимодействие металлов с растворами солей
Лабораторная работа
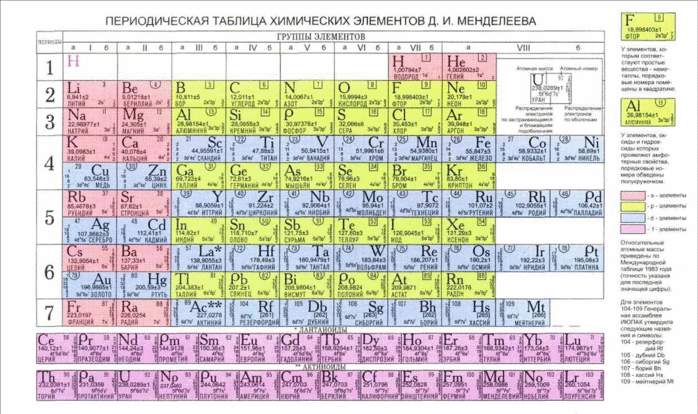
Тема: Моделирование построения периодической таблицы химических элементов.
Цель: Овладение умением по моделированию периодической таблицы химических элементов.
Задача: Закрепить знания по теме «Периодический закон Д.И. Менделеева и периодическая система химических элементов».
Обеспечивающие средства: Периодическая система элементов.
Теоретические основы
Д.И. Менделеев определил, что общее у всех элементов – атомная масса. Свойства элементов зависят периодически от атомных масс. Учение о строении атомов вскрыло глубокий физический смысл периодического закона. Главной характеристикой атома является не атомная масса, а положительный заряд ядра атома. Теория строения атомов объясняет периодическое изменение свойств элементов. Свойства химических элементов и свойства их соединений находятся в периодической зависимости от заряда ядра атома. Периодический закон записан графически в виде таблицы. Периодическая таблица химических элементов имеет горизонтальные ряды – периоды, в которых прослеживается периодичность изменения свойств элементов от металлических свойств к неметаллическим свойствам. А также вертикальные ряды – группы, в которых объеденены химические элементы, соединения которых имеют сходные свойства.
При моделировании построения периодической таблицы необходимо рассмотрите периодичность изменения свойств химических элементов в ряду: H, He, Li, Be, B, C, N, O, F, Ne, Na, Mg, Al, Si, P, S, Cl, Ar. Затем разбейте этот ряд на горизонтальные и вертикальные ряды согласно вопросам задания. В итоге объедините эти ряды в прямоугольную таблицу, укажите номер периода, группы, порядковый номер химического элемента.
Задание:
1. Расположите в порядке возрастания заряда ядра атома химические элементы 1,2,3 периодов.
2. Установите зависимость изменения химических свойств элементов от увеличения заряда ядра атома.
3. Расположите химические элементы в горизонтальные ряды в зависимости от увеличения заряда ядра атома и периодичности изменения свойств химических элементов.
1ряд ………..
2 ряд……….
3 ряд……….
4. Расположите химические элементы в вертикальные ряды в зависимости от числа электронов на последнем энергетическом уровне.
1 ряд 2 ряд 3 ряд
: : :
5. Постройте модель периодической таблицы для данных химических элементов. Укажите номер периода, группы и порядковый номер химического элемента.
6. Установите зависимость изменения химических свойств элементов и их соединений от заряда ядра атома в периодах и группах.
Контрольные вопросы
1 уровень
1. Какой ряд называется периодом? Какое число периодов имеет периодическая таблица?
2. Какой физический смысл имеет порядковый номер химического элемента и номер периода с точки зрения строения атома?
3. Как изменяются свойства химических элементов в группах главных подгруппахи в периодах?
4. Что объединяет химические элементы, входящие в одну группу? Какое число групп имеет периодическая таблица?
2 уровень
1.Запишите современную формулировку периодического закона.
2. Какое строение атома имеют химические элементы неметаллы и металлы?
3. Объясните, почему с ростом заряда ядра атома в периодах растут неметалические свойства элементов, а металлические уменьшаются?
4. Объясните, какой элемент Na или K обладает большими металлическими свойствами?
3 уровень
1. Какой химический элемент обладает большими неметаллическими свойствами сера или хлор, сера или кислород? Ответ сформулируйте с точки зрения строения атома и периодического закона.
2. Запишите электронные формулы строения атомов с порядковым номером 17 и 20. Какие свойства проявляют эти элементы? Какова их валентность?
Сформулируйте вывод по работе.
Лабораторная работа
Тема: Ознакомление с коллекциями образцов нефти, угля и продуктов их переработки, каучуков и образцами изделий из резины.
Цель: На основе коллекционного материала ознакомиться c образцами нефти, угля и продуктами их переработки, каучуками и образцами изделий из резины.
Задача: Закрепить знания по теме «Углеводороды и их природные источники».
Оборудование: Коллекции: «Нефть и продукты ее переработки», «Каучуки и образцы изделий из резины», «Уголь и продукты его переработки». Учебное пособие Габриелян О.С. «Химия»
Теоретические основы
Природными источниками различных углеводородов являются нефть, уголь, природный газ. Все перечисленное является источником получения энергии, а так же важнейшим химическим сырьем.
Нефть – это жидкий, горючий маслообразный минерал, имеющий окраску от светло-желтой до темно-коричневой, легче воды и практически в ней нерастворима. Нефть состоит из алканов, циклоалканов и ароматических углеводородов.
Уголь содержит 65 – 90% углерода. Уголь черного цвета твердое вещество отличается большой плотностью и блеском.
Каучуки – эластичные материалы, из которых путем специальной обработки получают резину. Сырой каучук липок, непрочен, а при небольшом понижении температуры становится хрупким. Чтобы придать изготовленным из каучука изделиям необходимую прочность и эластичность, каучук подвергают вулканизации – вводят в него серу и нагревают. Вулканизированный каучук называется резиной.
Натуральный каучук (НК) представляет высокомолекулярное соединение - полимер формула которого ( - СН2 – С = СН – СН2 -)n CH3
Синтетические каучуки (СК) производят разного вида.
СКБ – продукт совместной полимеризации бутадиена с другими непредельнми углеводородами.
Формула СК ( - СН2 – СН = СН – СН2 - )n
Выполнение работы
1. Ознакомление с коллекцией «Нефть и продукты ее переработки».
Рассмотрите коллекцию. Запишите образцы нефти и их отличие по составу. Запишите продукты переработки нефти и их применение.
2. Ознакомление с коллекцией «Каучуки и образцы изделий из резины».
Рассмотрите коллекцию. Запишите образцы каучуков и их отличие по составу. Запишите образцы изделий из резины и их применение.
3. Ознакомление с коллекцией «Уголь и продукты его переработки».
Рассмотрите коллекцию. Запишите образцы угля и их отличие по составу. Запишите продукты переработки угля и их применение.
Данные наблюдений занесите в таблицу.
| Образцы | Физические свойства | Применение |
| 1.Нефть . |
||
| 2. Каучук | ||
| 3. Уголь . |
Контрольные вопросы
1. Какие углеводороды входят в состав нефти?
2. Какие существуют методы переработки нефти?
3. Перечислите фракции перегонки нефти?
4. К каким органическим соединениям относятся каучуки?
5. Какие бывают синтетические каучуки?
6. На какие группы делятся каучуки по их назначению?
Тема: "Чистые вещества"
Белки. Функции
http://bambookes.ru/stuff/laboratornye_raboty/khimija/laboratornye_raboty_po_khimii_gabrieljan_10_klass/9-1-0-2586 - Лабораторные работы за 10 класс по УМК О.С. Габриелян
http://bambookes.ru/stuff/laboratornye_raboty/khimija/laboratornaja_rabota_14_svojstva_belkov/9-1-0-2597 - Лабораторная работа, свойства белков
http://bambookes.ru/stuff/onlajn_reshebniki_gdz/khimija/gdz_gabrieljan_11_klass_bazovyj_uroven_onlajn/7-1-0-7433 -Лабораторные работы по химии за 11 класс по УМК О.С.Габриелян
http://edu.znate.ru/docs/1562/index-4347-7.html - Лабораторные работы
Качественная реакция глюкозы с гидроксидом меди
http://orgchem.ru/chem4/vid/glyk_Cu.htm
| Скриншот | Учебный материал |
| Нет данных | |
- Расчеты содержания элементов в веществе по его формулам (в граммах, молях и массовых долях).
Пример 11. Из образца горной породы массой 25 г, содержащего минерал аргентит Ag2S, выделено серебро массой 5,4 г. Определите массовую долю аргентита в образце.
| Дано: m(образца) = 25 г m(Ag) = 5,4 г |
Решение 1. Для решения используем формулы: n = w(X) = 2. Находим химическое количество выделенного серебра: n(Ag) = 3. Находим химическое количество аргентита: n(Ag2S) : n(Ag) = 1 : 2 n(Ag2S) = 4. Определяем массу аргентита в образце горной породы: Mr(Ag2S) = 2Ar(Ag)+Ar(S) = 2·108 + 32 =248; M(Ag2S)= 248 г/моль m(Ag2S) = n(Ag2S) · M(Ag2S) = 0,025 моль · 248 г/моль = 6,2 г. 5. Находим массовую долю аргентита в образце горной породы: w(Ag2S) = Ответ: массовая доля аргентита в образце горной породы составляет 24,8%. |
| Найти w(Ag2S) |
- Установление эмпирической и молекулярной (истинной) формул по массовым долям элементов, входящих в состав вещества.
Пример 12. Установите молекулярную формулу вещества, если массовая доля углерода в нем составляет 26,67%, водорода – 2,22%, кислорода – 71,11%. Относительная молекулярная масса этого вещества равна 90.
| Дано: CxHyOz w(C) = 0,2667 (26,67%) w(H) = 0,0222 (2,22%) w(O) = 0,7111 (71,11%) Mr(CxHyOz) = 90 |
Решение 1. Для решения задачи используем формулы: w = n = 2. Находим химические количества элементов, входящих в состав вещества, приняв, что m(CxHyOz) = 100 г. m(C) = w(C) · m(CxHyOz) = 0,2667 · 100 г = 26,67 г. m(H) = w(H) · m(CxHyOz) = 0,0222 · 100 г = 2,22 г. m(O) = w(O) · m(CxHyOz) = 0,7111 · 100 г = 71,11 г. n(C) = n(H) = n(O) = 3. Определяем эмпирическую формулу вещества: n(C) : n(H) : n(O) = 2,22 моль : 2,22 моль : 4,44 моль. x : y : z = 1 : 1 : 2. Эмпирическая формула вещества – CHO2. 4. Устанавливаем истинную молекулярную формулу вещества: Mr(CHO2) = Ar(C) + Ar(H) + 2Ar(O) = 12 + 1 + 2·16 = 45; Mr(CHO2) : Mr(CxHyOz) = 45 : 90 = 1 : 2. Истинная молекулярная формула вещества – C2H2O4. Ответ: молекулярная формула вещества C2H2O4. |
| Найти x, y, z |
- Вычисление по уравнению химической реакции объемов газов по известному химическому количеству одного из веществ.
| Дано: n(Zn) = 0,5 моль |
Решение 1. Составляем уравнение реакции цинка с раствором соляной кислоты: 0,5 моля 0,5 моля Zn + 2HCl = ZnCl2 + H2 1 моль 1 моль 2. Для решения используем формулу: V = n · Vm. 3. По уравнению реакции находим химическое количество выделившегося водорода: n(H2) = n(Zn) = 0,5 моль. 4. Определяем объем выделившегося водорода: V(H2) = n(H2) · Vm = 0,5 моль · 22,4 дм3/моль = 11,2 дм3. Ответ: выделится водород объемом 11,2 дм3. |
| Найти V(H2) |
- Расчет объемных отношений газообразных веществ по химическим уравнениям.
Пример 14. Какой объем оксида углерода(IV) образуется при сгорании ацетилена объемом 5 дм3(н.у.)?
| Дано: V(C2H2) = 5 дм3 |
Решение 1. Составляем уравнение реакции горения ацетилена: 5 дм3 X дм3 2C2H2 + 5O2 = 4CO2 + 2H2O 2V 4V 2. Для решения, согласно закону объемных отношений газов при химических реакциях, используем формулу: V(C2H2) : V(CO2) = 2 : 4; V(C2H2) : V(CO2) = 1 : 2. 3. Определяем объем выделившегося водорода: V(CO2) = 2V(C2H2) = 2· 5 дм3 = 10 дм3. Ответ: образуется оксид углерода(IV) объемом 10 дм3. |
- Вычисление относительной плотности и молярной массы газов.
Пример 15. Вычислите молярную массу газа, относительная плотность которого по водороду равна 32. Рассчитайте относительную плотность этого газа по воздуху.
| Дано: M(возд.) » 29 г/моль |
Решение 1. Для решения используем формулу: 2. Вычисляем молярную массу газа: M(газа) = 3. Определяем относительную плотность газа по воздуху: Ответ: молярная масса газа – 64 г/моль, относительная плотность этого газа по воздуху – 2,207. |
| Найти M(газа) |
- Вычисление молярной концентрации газов.
| Дано: V = 5 дм3 n(A) = 2 моль n(B) = 3 моль |
Решение 1. Для решения используем формулу: c(X) = 2. Вычисляем молярные концентрации газов: c(A) = c(B) = Ответ: молярная концентрация вещества A – 0,4 моль/дм3, а молярная концентрация вещества B – 0,6 моль/дм3. |
| Найти c(A), c(B) |
- Расчеты по термохимическим уравнениям.
Пример 17. При сжигании серы массой 1 г выделилось количество теплоты 9,28 кДж. Составьте термохимическое уравнение реакции.
| Дано: m(S) = 1 г Q' = 9,28 кДж |
Решение 1. Составляем уравнение термохимическое реакции горения серы: 0,0313 моль +9,28 кДж S + O2 = SO2 ± Q 1 моль 2. Для решения задачи используем формулу: n = 3. Находим химическое количество серы: n(S) =  = 0,0313 моль. = 0,0313 моль.3. Находим тепловой эффект реакции горения серы и составляем термохимическое уравнение: Q =  = 296,5 кДж. = 296,5 кДж.S + O2 = SO2 + 296,5 кДж Ответ: S + O2 = SO2 + 296,5 кДж |
| Найти Q |
- Вычисления по уравнениям реакций, протекающих в растворах.
Пример 18. Какая масса раствора соляной кислоты с массовой долей HCl 20% потребуется для нейтрализации раствора гидроксида натрия массой 45 г с массовой долей NaOH 15%?
| Дано: w(HCl) = 0,2 (20%) w(NaOH) = 0,15 (15%) mр-ра(NaOH) = 45 г |
Решение 1. Составляем уравнение реакции нейтрализации: 0,169 моль 0,169 моль NaOH + HCl = NaCl + H2O 1 моль 1 моль 2. Для решения используем формулы: w(в-ва) = n = 3. Вычисляем массу и химическое количество NaOH: m(NaOH) = mр-ра(NaOH) · w(NaOH) = 45 г · 0,15 = 6,75 г Mr(NaOH) = Ar(Na) + Ar(O) + Ar(H) = 23 + 16 + 1 = 40; M(NaOH) = 40 г/моль; n(NaOH) = 4. Определяем по уравнению реакции химическое количество HCl: n(HCl) = n(NaOH) = 0,169 моль. 5. Вычисляем массу чистого вещества и массу раствора HCl: Mr(HCl) = Ar(H) + Ar(Cl) = 1 + 35,5 = 36,5; M(HCl) = 36,5 г/моль; m(HCl) = n(HCl) · M(HCl) = 0,169 моль · 36,5 г/моль = 6,2 г mр-ра(HCl) = Ответ: потребуется раствор соляной кислоты массой 31 г. |
- Расчет массы (объема вещества), необходимого для приготовления раствора с заданной массовой долей (молярной концентраций).
Пример 19. Какой объем раствора серной кислоты плотностью 1,8 г/см3 с массовой долей H2SO4 88% нужно взять для приготовления раствора кислоты объемом 300 см3 и плотностью 1,3 г/см3 с массовой долей H2SO4 40%?
| Дано: w1(H2SO4) = 0,88 (88%) ρ1(р-ра) = 1,8 г/см3 w2(H2SO4) = 0,4 (40%) ρ2(р-ра) = 1,3 г/см3 V2(р-ра) = 300 см3 |
Решение 1. Для решения задачи используем формулы: w(в-ва) = 2. Определяем массу полученного раствора и массу H2SO4 в нем: m2(р-ра) = ρ2(р-ра) · V2(р-ра) = 1,3 г/см3 · 300 см3 = 390 г. m2(H2SO4) = m2(р-ра) · w2(H2SO4) = 390 г · 0,4 = 156 г. 3. Находим массу и объем исходного раствора: m1(H2SO4) = m2(H2SO4) = 156 г. m1(р-ра) =  = = V1(р-ра) =  = = Ответ: потребуется раствор кислоты объемом 98,5 см3. |
| Найти V1(р-ра) |
Пример 20. Какой объем раствора серной кислоты плотностью 1,035 г/см3 с массовой долей H2SO4 5,5% нужно взять для приготовления раствора серной кислоты объемом 300 см3 с молярной концентрацией H2SO4 0,25 моль/дм3?
| Дано: w1(H2SO4) = 5,5 (0,055%) ρ1(р-ра) = 1,035 г/см3 с2(H2SO4) = 0,25 моль/дм3 V2(р-ра) = 300 см3 |
Решение 1. Для решения задачи используем формулы: c(X) = 2. Находим химическое количество H2SO4 в полученном растворе: n2(H2SO4) = c2(H2SO4) · V2(р-ра) = 0,25 моль/дм3 · 0,3 дм3 = = 0,075 моль. 3. Находим массу H2SO4 в исходном растворе: n1(H2SO4) = n2(H2SO4) = 0,075 моль. Mr(H2SO4) = 2Ar(H) + Ar(S) + 4Ar(O) = 2·1 + 32 + 4·16 = 98 M(H2SO4) = 98 г/моль. m2(H2SO4)= n2(H2SO4)· M(H2SO4)= 0,075 моль · 98 г/моль = = 7,35 г. 4. Находим массу и объем исходного раствора: m1(р-ра) =  = = V1(р-ра) =  = = Ответ: потребуется раствор кислоты объемом 129,1 см3. |
| Найти V1(р-ра) |
- Определение практического выхода продукта реакции.
Пример 21. При пропускании сероводорода объемом 2,8 дм3 (при н.у.) через избыток раствора сульфата меди(II) образовался осадок массой 11,4 г. Вычислите выход продукта реакции.
| Дано: V(H2S) = 2,8 дм3 m практ.(CuS) = 11,4 г |
Решение 1. Составляем уравнение реакции нейтрализации: 0,125 моль 0,125 моль CuSO4 + H2S = CuS↓ + H2SO4 1 моль 1 моль 2. Для решения задачи используем формулы: η =  ; n = ; n =3. Находим химическое количество сероводорода: n(H2S) =  = 0,125 моль. = 0,125 моль.4. Определяем химические количества сульфида меди(II) (теоретически возможное и практически полученное): nтеор.(CuS) = n(H2S) = 0,125 моль. Mr(CuS) = Ar(Cu) + Ar(S) = 64 + 32 = 96 M(CuS) = 96 г/моль. nпракт.(CuS) = 5. Вычислите выход продукта реакции. η(CuS) =  = = Ответ: выход продукта реакции составляет 95,2%. |
Принцип Ле Шателье
Комментарии (2657)











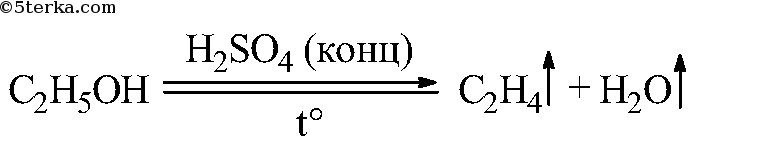
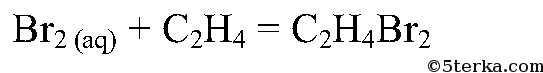



Начало Сюда 1 2 3 … 438 439 440 441 442 443 Туда Последняя